Charakterystyka komórek macierzystych
W wyniku intensyfikacji badaÅ� nad biologiÄ� komórek macierzystych i ich zastosowaniem w odnowie narzÄ�dów i tkanek powstaÅ� zupeÅ�nie nowy kierunek medycyny – medycyna regeneracyjna. Jej potencjalne osiÄ�gniÄ�cia w XXI wieku dajÄ� szansÄ� na porównywany ogromny postÄ�p, jaki dokonaÅ� siÄ� w XX wieku po wprowadzeniu do leczenia antybiotyków. WÅ�aÅ�ciwe wykorzystanie komórek macierzystych w różnych rodzajach terapii nastÄ�pi wtedy, kiedy uda siÄ� pokierowaÄ� ich rozwojem, doprowadzajÄ�c do tworzenia swoistych tkanek i narzÄ�dów. Dzisiaj na wiele pytaÅ� zwiÄ�zanych z przebiegiem i sterowaniem procesami regeneracji narzÄ�dów i tkanek nie można jeszcze udzieliÄ� jednoznacznej odpowiedzi (1).
W rozwoju komórek macierzystych wyróżnia siÄ� dwa okresy: embrionalny i postembrionalny.
1) W czasie trwania embriogenezy wyróżnia siÄ� nastÄ�pujÄ�ce grupy komórek:
• totipotencjalne (totipotentne) – sÄ� to blastomery wchodzÄ�ce w skÅ�ad dzielÄ�cej siÄ� zygoty, zdolne do wyksztaÅ�cenia caÅ�ego organizmu i Å�ożyska,
• pluripotencjalne (pluripotentne) – mogÄ� daÄ� poczÄ�tek każdemu typowi dojrzaÅ�ych komórek pochodzÄ�cych z trzech listków zarodkowych: mezodermy, ektodermy i endodermy,
• multipotencjalne (multipotentne) – mogÄ� przeksztaÅ�caÄ� siÄ� w wiÄ�cej niż jeden typ komórek w obrÄ�bie danego listka zarodkowego; do tej grupy należÄ� np. komórki macierzyste krwi pÄ�powinowej.
2) Okres postembrionalny to czas, w którym wystÄ�pujÄ� dojrzaÅ�e komórki macierzyste (adult stem cells), sÄ� one:
• unipotencjalne (unipotentne) – wystÄ�pujÄ� w niewielkich liczbach w tkankach organizmu, sÄ� zdolne do różnicowania w obrÄ�bie jednej linii komórkowej (2-5).
Wiele obecnych badaÅ� skupia siÄ� na identyfikacji, charakterystyce i izolowaniu komórek macierzystych z dorosÅ�ego organizmu w nadziei, iż komórki te mogÄ� okazaÄ� siÄ� użyteczne w leczeniu i odnowie dojrzaÅ�ych, uszkodzonych tkanek, czy to przez egzogennÄ� terapiÄ� komórkowÄ�, czy też dziÄ�ki aktywacji endogennych komórek macierzystych. Do dziÅ� wiÄ�kszoÅ�Ä� wyodrÄ�bnionych dojrzaÅ�ych komórek macierzystych ma jednak ograniczony potencjaÅ� różnicowania siÄ�, a osiÄ�gniÄ�cie nieskoÅ�czonej proliferacji i ekspansji komórek macierzystych w hodowli wciÄ�ż nie jest Å�atwe.
Cechy charakterystyczne komórek macierzystych to:
• prosta budowa, morfologicznie sÄ� pozbawione cech różnicowania,
• zdolnoÅ�Ä� do samoodnowy w ciÄ�gu caÅ�ego życia organizmu, w zwiÄ�zku z tym ich populacja nie zmniejsza siÄ� i nie zużywa,
• dzielÄ�c siÄ� dajÄ� dwie nierówne komórki potomne, z których jedna wiÄ�ksza pozostaje nadal komórkÄ� macierzystÄ�, a druga, mniejsza ulega ostatecznemu liniowemu zróżnicowaniu,
• wykazujÄ� ekspresjÄ� swoistych biaÅ�ek, takich jak: c-kit, Thy1 (6, 7).
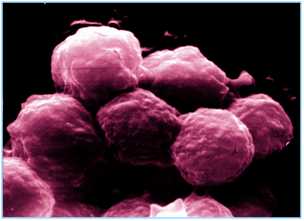 |
 |
Fot. 1, 2. Hodowla komórek MIC-1 w mikroskopie skaningowym
Spis publikacji:
1. Vogel G.: How can a skin cell become a nerve cell? Science 2005, 309: 85.
2. Alison M.R., Poulsom R., Forbes S., Wright N.A.: An introduction to stem cells. J. Pathol. 2002, 197: 419–423.
3. Cegielski M., CaÅ�kosiÅ�ski I., DziÄ�giel P., Zabel M.: Search for stem cells for pulmonary alveolar epithelium. Bull. Vet. Inst. Pulawy 2004, 48: 471–475.
4. Cogle C.R., Guthrie S.M., Sanders R.C., Allen W.L., Scott E.W., Petersen B.E.: An overview of steam cell research and regulatory issues. Mayo Clin. Proc. 2003, 78: 993–1003.
5. Lee O.K., Kuo T.K., Chen W.M., Lee K.D., Hsieh S.L., Chen T.H.: Isolation of multipotent mesenchymal stem cells from umbilical cord blood. Blood 2004, 103: 1669–1675.
6. Emura M.: Stem cells of the respiratory epithelium and their in vitro cultivation. In Vitro Cell. Dev. Biol. Anim. 1997, 33: 3–14.
7. Zhou S., Schuetz J.D., Bunting K.D., Colapietro A.M., Sampath J., Morris J.J., Lagutina I., Grosveld G.C., Osawa M., Nakauchi H., Sorrentino B.P.: The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat. Med. 2001, 7: 1028–1034.
8. Pituch-Noworolska A., Majka M., Janowska-Wieczorek A., Baj-Krzyworzeka M., Urbanowicz B., Malec E., Ratajczak M.Z.: Circulating CXCR4-positive stem/progenitor cells compete for SDF-1 positive niches in bone marrow, muscle and neural tissues: an alternative hypothesis to stem cell plasticity. Folia Histochem. Cytobiol. 2003, 41: 13–21.
9. Bartholomew A., Sturgeon C., Siatskas M., Ferrer K., McIntosh K., Patil S., Hardy W., Devine S., Ucker D., Deans R., Moseley A., Hoff man R.: Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp. Hematol. 2002, 30: 42–48.
10. Chamberlain G., Fox J., Ashton B., Middleton J.: Concise review: mesenchymal stem cells: their phenotype, diff erentiation capacity, immunological features, and potential for homing. Stem Cells 2007, 25: 2739–2749.
11. Corcione A., Benvenuto F., Ferretti E., Giunti D., Cappiello V., Cazzanti F., Risso M., Gualandi F., Mancardi G.L., Pistoia V., Uccelli A.: Human mesenchymal stem cells modulate B-cell functions. Blood 2006, 107: 367–372.
12. Javazon E.H., Beggs K.J., Flake A.W.: Mesenchymal stem cells: paradoxes of passaging. Exp. Hematol. 2004, 32: 414–425.
13. Matsumoto R., Omura T., Yoshiyama M., Hayashi T., Inamoto S., Koh K.R., Ohta K., Izumi Y., Nakamura Y., Akioka K., Kitaura Y., Takeuchi K., Yoshikawa J.: Vascular endothelial growth factor-expressing mesenchymal stem cell transplantation for the treatment of acute myocardial infarction. Arterioscler. Thromb. Vasc. Biol. 2005, 25: 1168–1173.
14. Tsuchiya H., Kitoh H., Sugiura F., Ishiguro N.: Chondrogenesis enhanced by overexpression of sox9 gene in mouse bone marrow-derived mesenchymal stem cells. Biochem. Biophys. Res. Commun. 2003, 301: 338–343.
15. Zhang X.S., Linkhart T.A., Chen S.T., Peng H., Wergedal J.E., Guttierez G.G., Sheng M.H., Lau K.H., Baylink D.J.: Local ex vivo gene therapy with bone marrow stromal cells expressing human BMP4 promotes endosteal bone formation in mice. J. Gene Med. 2004, 6: 4–15.
Stem Cells Spin S.A.
ul. Teofila Lenartowicza 6, 51-140 Wroclaw
tel +48 71 326 54 07 / fax +48 71 735 93 47
ul. Teofila Lenartowicza 6, 51-140 Wroclaw
tel +48 71 326 54 07 / fax +48 71 735 93 47






